由新型冠状病毒SARS-CoV-2(以下简称新冠)引发的COVID-19全球大流行依旧在传播。本文将从新冠的结构、在研疫苗的技术平台及优劣势、最受期待的疫苗所处研发阶段、已进入3期临床研究的疫苗主要研究结果分享等几个角度出发,为大家做一个快速的干货梳理概览。
由新型冠状病毒SARS-CoV-2(以下简称新冠)引发的全球疫情依旧在传播,并对人类生命健康及经济发展带来严重的威胁。为保护全人类,开发安全及有效的疫苗成为控制新冠疫情扩散的必要之策。
由于新冠的全基因组序列与SARS-CoV-1相似,并且在人体中结合的受体都是ACE2,从SARS-CoV-1的疫苗开发中获得对于新冠疫苗开发的启示显得尤其重要。通常,疫苗的研发需要经历约10-15年的周期,而新冠疫苗的研发节奏非常快,一年内,多个科研机构与不同技术平台的候选疫苗井喷式地出现,包括临床试验在内的整个疫苗开发周期也大大缩短,平均仅花费15-18个月。
在国际间科研机构的精诚合作及研发费用投入的共同助力下,截止至2020年12月10日,全球已经有214个候选疫苗分别处于不同的研发阶段,其中,有52个疫苗已经进入临床研究阶段,9个疫苗正在进行III期临床实验,3个疫苗已经获得了附条件的上市批复或是紧急使用授权,还有1个正在准备递交美国紧急使用授权申请。
本文将从新冠的结构、在研疫苗的技术平台及优劣势、最受期待的疫苗所处研发阶段、已进入3期临床研究的疫苗主要研究结果分享等几个角度出发,为大家做一个快速的干货梳理概览。
温馨提示
本文部分内容仅供医疗专业人士阅读,不能作为您是否接种疫苗的参考。
为节省您的阅读时间,并尽可能降低阅读疲劳,我们尽量少写文字、多用图。对于每幅图,我们详细标注了参考文献,本文中的所有文献全部可以在pubmed上免费下载全文。
新冠的结构及在研疫苗的技术平台
首先,让我们回顾一下SARS-CoV,MERS-CoV,SARS-CoV-2的基因组织形式及开放基因编码框(图1):
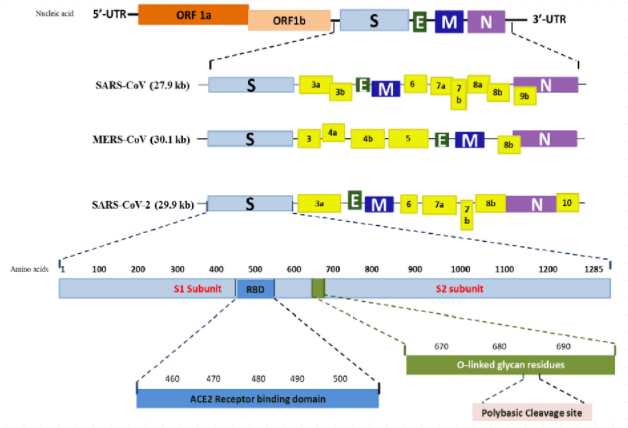
图1
而后,从SARS-CoV-2病毒的组成入手,就可以直观地去理解由全球多个科研机构全方位开发的不同技术平台的疫苗(图2*):
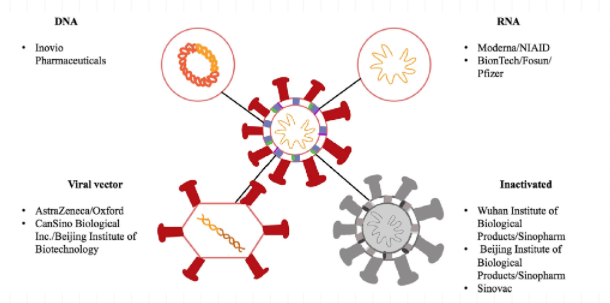
图2*:来源于文献图片,
未全部列出所有在研公司
下面的图3总结了不同技术平台的疫苗所针对的靶抗原,从中我们可以发现,在研的绝大多数疫苗的靶点抗原都是新冠病毒的刺突蛋白S:
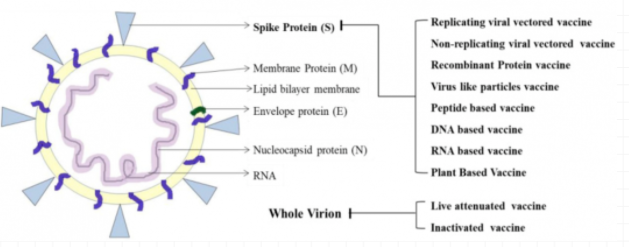
图3
图4则展现了全球在研不同疫苗候选平台的分布:
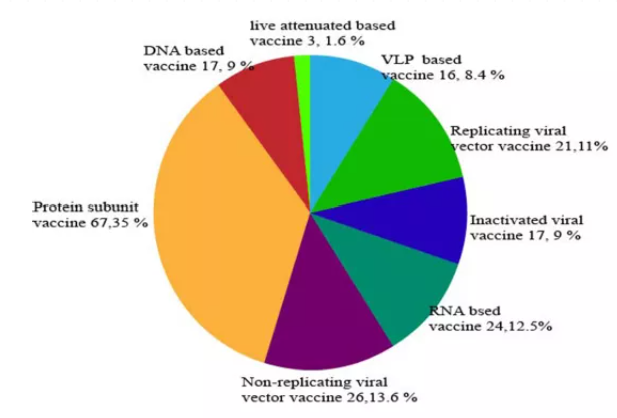
图4
按照图中所显示的占比份额,由多到少进行排序,依次为:蛋白亚单位(35%),非复制的病毒载体疫苗(13.6%),RNA疫苗(12.5%),可复制的病毒载体疫苗(11%),灭活疫苗(9%),NDA疫苗(9%),病毒样颗粒疫苗(VLP,8.4%),减毒活疫苗(1.6%)。

在下表中,我们对不同技术平台的疫苗进行了优劣势分析,并同时举例,方便大家有亲切直观的印象:
表1:不同技术平台疫苗的优劣势分析
主要疫苗研究结果分享
目前,由于新冠疫苗研究周期的革命性加速,使得疫苗的有效性及安全性成为大家讨论的焦点。在本段落,我们就将对疫苗从研发到生产的流程及周期、以及目前已进入3期临床研究的疫苗主要研究结果进行讨论。
首先,通过图5与图6的对比,我们可以看到传统疫苗与COVID-19疫苗从研发到生产的流程及周期的不同:
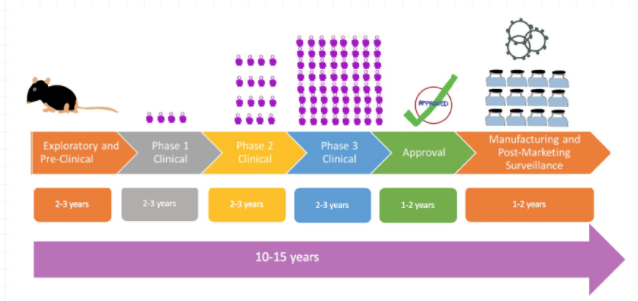
图5:传统疫苗研发生产流程及周期

图6:COVID-19疫苗研发生产流程及周期
接下来,让我们聚焦目前进入临床III期的疫苗(表2),并总结一下这些研究的安全性有效性数据(表3-4、图7-8)。
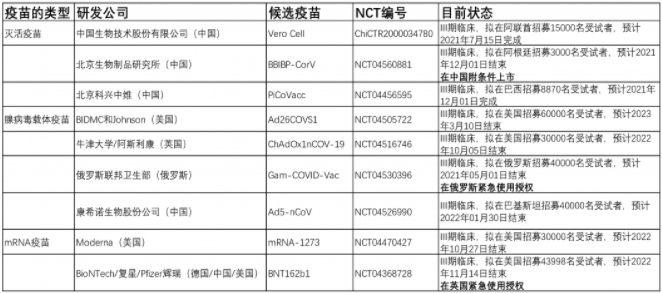
表2:目前进入临床III期疫苗列表

表3:我国进入3期临床试验的灭活疫苗已发表的有效性和安全性结果总结
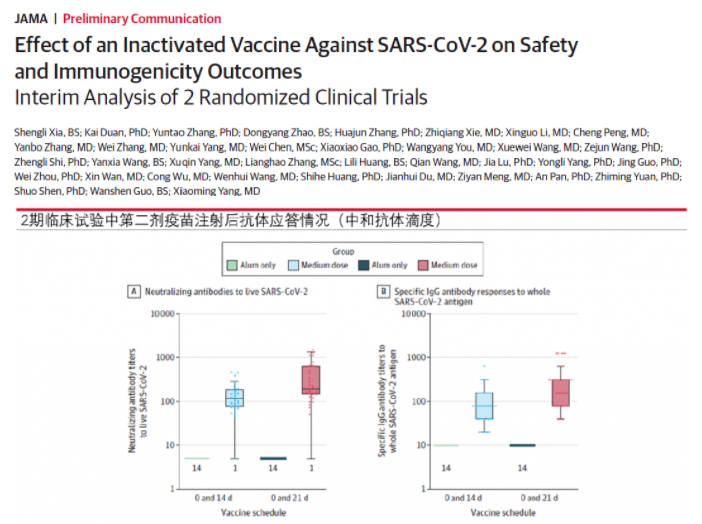
图7:New Crown 2期临床试验中第二次注射疫苗后抗体应答情况
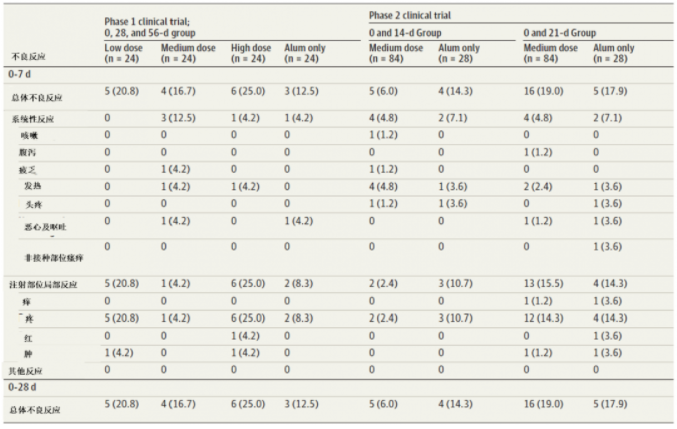
表4:New Crown 2期临床试验中第二次注射疫苗后不良反应发生率
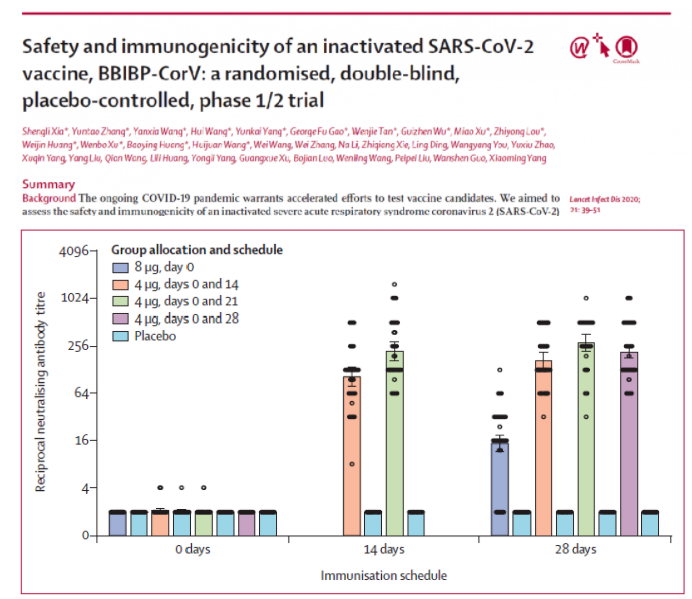
图8: 北生所BBIBP-CorV疫苗在不同免疫阶段的中和抗体滴度
同样,北生所的疫苗最主要的系统性不良反应是发热(18–59 years, one [4%] in the 2 μg group, one [4%]in the 4 μg group, and two [8%] in the 8 μg group; ≥60 years, one [4%] in the 8 μg group)。所有不良反应均为轻、中度,且无严重的不良事件。
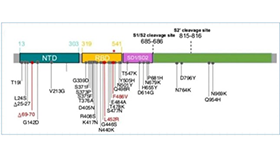
关于国内的三种灭活疫苗,依据发表的关于该疫苗研究的第一篇文献,伯杰医疗对三款疫苗的序列在数据库中进行了检索。其中武生所和科兴疫苗研究文献中公开了相关种子株的序列号。检索到得北生所得这篇文献并没有公开种子株序列。将三家疫苗种子株序列与新冠病毒代表株序列Wuhan-hu-1进行对比,其中科兴为S型,北生所和武生所疫苗属于L型,与Wuhan-hu-1接近。具体信息见下表。
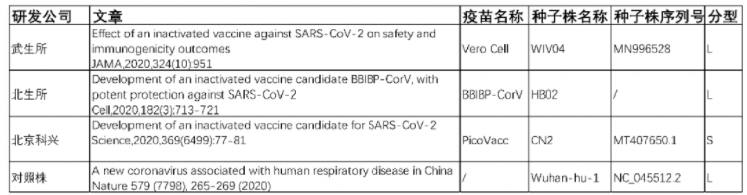
表5
目前,北生所疫苗已经附条件上市,并全民免费接种。截止1月25日,我国已累计开展新冠病毒疫苗接种1500多万剂次,进一步证明了我国新冠病毒疫苗具备良好的安全性。中国新冠病毒疫苗上市为全球战胜疫情注入信心,也为疫苗成为全球公共产品提供有力支撑。
参考文献
[1] Sharma et al. Frontiers in Immunology. 2020, October 2020, 11, 585354.
[2] K. Rawat et al. European Journal of Pharmacology 892 (2021) 173751.
[3] Tafere Mulaw Belete,Infection and Drug Resistance 2021:14 151–161.
[4] Xia S, Duan K, Zhang Y, et al. Effect of an inactivated vaccine against SARS-CoV-2 on safety and immunogenicity outcomes: interim analysis of 2 randomized clinical trials. JAMA. 2020;324 (10):951–960.
[5] Xia S, Zhang Y, Wang Y, et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBIBP-CorV: a randomised, double-blind, placebo-controlled, phase 1/2 trial. Lancet Infect Dis. 2020;21(1):15.
[6] Hui Wang, Yuntao Zhang, et al. Development of an Inactivated Vaccine Candidate, BBIBP-CorV, with Potent Protection against SARSCoV-2. Cell 2020, 182, 713–721.
[7] Science,2020,369(6499):77-81.
[8] Nature,2020, 579(7798),256-269.
上海伯杰医疗科技有限公司是一家致力于感染性病原体分子诊断试剂研发和应用,深耕于多重荧光PCR诊断试剂和痕量病毒二代测序试剂及相关服务的国家高新技术企业。公司围绕感染性病原体这一主线,从诊断试剂、诊断仪器、测序服务和医检所服务等多个面提供全套解决方案。公司秉承“勇于创新,质量为先”的方针,为医疗机构、疾控公卫、高校科研等合作伙伴提供优质产品与服务。

全国客服电话:400-860-3688













.jpg)